
ISO 13485
Conformité des dispositifs médicaux

Conformité des dispositifs médicaux

Orienter le cycle de vie des logiciels

Gérer efficacement les risques

Aborder les risques de cybersécurité

Règlement sur les dispositifs médicaux

Conformité et Cybersécurité

Sécurité des données de l'organisation

Systèmes d'IA pour la santé

Alignement sur les normes américaines

Systèmes de gestion de l'IA

Réglementation américaine du système de qualité

Règlement sur les dispositifs médicaux de diagnostic in vitro

Validation du système informatique
Actions correctives et préventives

Évaluation du système qualité

Nous vous aidons à mettre en place un environnement réglementaire et de qualité pour vos logiciels de dispositifs médicaux qui soit non seulement conforme, mais également adapté à votre organisation. Une telle solution reflétera votre philosophie, votre structure et votre réalité quotidienne, en reliant les personnes, les processus et les objectifs en une seule unité fonctionnelle.
Nous reconnaissons que la conformité n'est pas la seule priorité de votre organisation. Vous avez vos plans d'affaires, vos délais de lancement et vos objectifs d'équipe. Nous ne plaçons pas les activités réglementaires ou liées à la qualité au-dessus de toutes les autres ; nous montrons plutôt comment chaque service peut collaborer pour atteindre ses objectifs de manière harmonisée : être rapide, conforme et efficace à la fois.
Nous vous guiderons à travers les normes spécifiques, mais notre véritable objectif est de vous aider à comprendre comment toutes ces normes s'articulent et fonctionnent ensemble comme un système cohérent.
Nous comprenons que votre objectif n'est pas seulement d'être conforme, mais aussi de réussir sur le marché, en restant innovant, efficace et suffisamment rapide pour devancer la concurrence tout en fournissant des produits sûrs et de haute qualité.
La compréhension mutuelle entre les personnes et les services est essentielle. Nous pensons que toutes les équipes de votre entreprise se soucient de la qualité ; parfois, elles ont simplement une vision différente de ce que signifie la qualité ou de la manière dont elle peut être atteinte. Nous aidons à harmoniser ces points de vue afin que la qualité devienne un langage commun et non un sujet de friction.
Nous vous aiderons à créer un environnement conforme que vos employés comprennent, où ils travaillent plus rapidement, communiquent mieux et apprécient de faire partie d'un système de gestion de la qualité moderne et significatif.
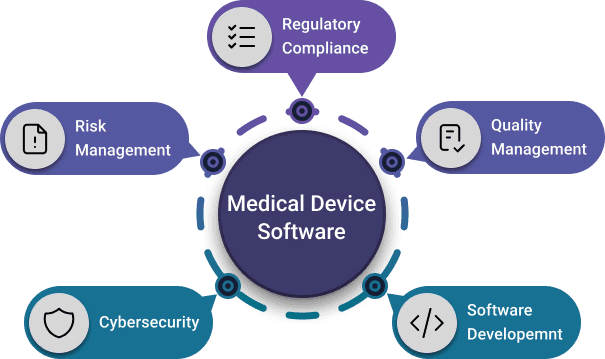
QMLogic offre des services de conseil complets pour le cycle de vie des logiciels pour dispositifs médicaux.
Les normes avec lesquelles nous travaillons constituent la base de la conformité pour toute entreprise développant des logiciels dans un environnement réglementé de dispositifs médicaux.
Au fil des ans, nous avons aidé nos clients dans de nombreux domaines, de la mise en place de systèmes de gestion de la qualité et l'élaboration de stratégies réglementaires à la mise en œuvre de processus de gestion des risques et de cybersécurité et à leur intégration dans des solutions eQMS modernes.
Grâce à ce travail, nous avons acquis une expertise approfondie de l'écosystème complexe des normes et réglementations des marchés européen et américain.
Cela nous permet d'offrir à nos clients des services de conseil complets pour les logiciels médicaux, combinant à la fois les perspectives réglementaires et techniques.

Chacune des principales normes et réglementations relatives aux dispositifs médicaux traite d'un aspect spécifique d'une même réalité. Il ne s'agit pas de documents isolés ; ensemble, ils définissent un réseau d'activités connectées qui couvrent l'ensemble du cycle de vie des logiciels, de la conception et du développement à la maintenance, en passant par le contrôle de l'efficacité et de la sécurité sur le marché.
Au lieu de laisser les processus et les normes coexister, nous les intégrons afin de garantir que votre organisation fonctionne comme un système bien orchestré.
Nous mettons en œuvre les normes dans un cadre pratique adapté aux besoins de votre organisation.

Nous combinons notre connaissance de la réglementation avec une réflexion pratique sur le développement de votre organisation, notamment sa taille, sa structure et son rythme de croissance.
Chaque entreprise avec laquelle nous travaillons se trouve à une étape différente de son parcours. Certaines construisent leurs premiers systèmes, d'autres se développent rapidement après avoir réalisé des investissements, et beaucoup optimisent des environnements de qualité matures.
Nous nous adaptons à votre contexte, à votre taille, à votre structure et à vos priorités afin de concevoir des solutions qui vous conviennent aujourd'hui et de créer les bases qui vous permettront d'aller de l'avant.
Nous abordons la conformité de manière pratique. Pour les petites équipes, cela signifie vous aider à établir ce qui est essentiel et efficace sans complexité inutile. Pour les grandes organisations, il s'agit d'accroître l'efficacité, d'éviter les activités redondantes et de maintenir la conformité pleinement intégrée dans les opérations complexes de l'entreprise.
La conformité réglementaire sera construite autour de la dynamique de votre organisation.
Nous mettons toujours l'accent sur la connexion : les équipes, les systèmes et l'alignement des objectifs commerciaux et réglementaires. Il en résulte un environnement de qualité qui évolue naturellement avec votre organisation.
Nous ne nous contentons pas d'expliquer ce qui doit être fait, nous vous aidons à le réaliser
Nous agissons comme une extension de votre équipe, en traduisant les exigences réglementaires en actions pratiques.
Notre équipe vous aidera à :


Du concept réglementaire au processus opérationnel, nous rendons la conformité tangible.
Notre implication couvre l'ensemble du cycle de vie des logiciels pour dispositifs médicaux, de l'idée initiale aux activités post-commercialisation :
Définition de la classification des produits et de la voie de conformité.
Garantie de la conformité de la documentation technique et des enregistrements aux normes.
Création de fichiers robustes et intégration de ceux-ci dans le cycle de vie de vos produits.
Soutien à la conformité continue et au suivi des performances.
Que vous ayez besoin de concevoir, de connecter ou de transformer des éléments spécifiques de votre environnement réglementaire et de conformité, nous vous aidons à le faire de manière efficace et conforme à toutes les réglementations applicables, telles que ISO 13485, ISO 14971, IEC 62304, MDR 2017/745 et 21 CFR 820.
La mise en œuvre et le maintien de la conformité dans le secteur des logiciels pour dispositifs médicaux ne sont plus possibles sans une base numérique moderne.
L'interprétation des normes, le conseil et même les efforts de mise en œuvre perdent leur valeur à long terme s'ils ne sont pas soutenus par un système électronique de gestion de la qualité (eQMS) efficace.
De nombreuses entreprises hésitent à numériser leur QMS, craignant souvent que les outils ne soient pas adaptés à leur structure ou ne passent pas les audits réglementaires ou les inspections de la FDA.
Mais le véritable risque ne réside pas dans la transformation, mais dans la stagnation. L'absence d'un eQMS correctement mis en œuvre entraîne des frais réglementaires, une inefficacité et des coûts de maintenance croissants.
Nous vous aidons à :
Nous pensons que la conformité à long terme ne peut être atteinte que grâce à des solutions numériques fonctionnelles et surveillées.
Ces outils QMS modernes garantissent que votre organisation reste conforme tout en conservant son agilité, sa modernité et son efficacité.

Votre SMQ définit le mode de fonctionnement de votre organisation. Mais la rédaction d'un processus n'est que la première étape. La véritable transformation se produit lorsque ces processus prennent vie dans un environnement numérique moderne utilisé quotidiennement par vos collaborateurs.
Construisons ensemble une infrastructure moderne et connectée pour votre organisation, qui prend en charge toutes les normes de manière transparente et transforme votre SMQ en un système d' excellence opérationnelle, et pas seulement de conformité.
La transformation se produit lorsque les processus cessent d'être décrits et commencent à être vécus.
Nous fournissons des services complets de conseil en matière de logiciels pour dispositifs médicaux et de mise en œuvre de la conformité qui couvrent l'ensemble du processus, depuis la définition de votre stratégie réglementaire et la conception de processus internes conformes jusqu'à la mise en œuvre de toutes les normes et réglementations pertinentes au sein d'un système cohérent et interconnecté.
L'ensemble des normes et réglementations que nous suivons sont étroitement liées. Elles abordent des défis similaires sous des angles différents et, lorsqu'elles sont mises en œuvre ensemble, elles se renforcent naturellement les unes les autres.
Dans les sections suivantes, nous illustrons comment ces cadres sont liés, comment la conformité à l'un renforce votre alignement avec les autres, et pourquoi nous nous concentrons spécifiquement sur cet ensemble de normes.
Les normes suivantes sont celles qui sont les plus pertinentes pour les logiciels médicaux, et sont celles que chaque organisation rencontrera lorsqu'elle mettra en place une organisation conforme, sûre et moderne dans le domaine des dispositifs médicaux.
Créer un environnement conforme, cohérent et efficace qui évite les redondances et les complexités inutiles.
Chez QMLogic, nous donnons aux organisations les moyens de révolutionner leurs systèmes de gestion de la qualité (SMQ) grâce à des outils de numérisation et d'automatisation de pointe. En tirant parti de Jira, Confluence, SharePoint, Power Platform et de solutions sur mesure, nous concevons des systèmes efficaces, automatisés et conformes à la norme ISO 13485, adaptés à vos besoins uniques.
Développement de logiciels pour dispositifs médicaux
QMLogic fournit des services de conseil réglementaire fiables pour les dispositifs médicaux et une assistance logicielle en matière de conformité réglementaire des dispositifs médicaux, vous guidant du développement à la certification réussie.
Services
Informations
Contact Details